Quimica 10°
NOMENCLATURA QUÍMICA INORGÁNICA
La nomenclatura química es un sistema de
símbolos y nombres, tanto para los elementos químicos como para los
compuestos que resultan de las combinaciones químicas. El lenguaje de la
química es universal, de tal manera que para el químico, el nombre de
una sustancia, no solo la identifica sino que revela su fórmula y
composición. La Unión Internacional de Química Pura y Aplicada (IUPAC)
se reúne periódicamente con el fin de fijar las normas que se deben
seguir para unificar el lenguaje y las técnicas de publicación.
Nomenclatura sistemática
También llamada nomenclatura por atomicidad, estequiométrica o de IUPAC. Se basa en nombrar a las sustancias usando PREFIJOS numéricos griegos que indican la atomicidad de cada uno de los elementos presentes en cada molécula. La atomicidad indica el número de átomos de un mismo elemento en una molécula, como por ejemplo el agua con fórmula H2O, que significa que hay un átomo de oxígeno y dos átomos de hidrógeno presentes en cada molécula de este compuesto, aunque de manera más práctica, la atomicidad en una fórmula química también se refiere a la proporción de cada elemento en una cantidad determinada de sustancia. En este estudio sobre nomenclatura química es más conveniente considerar a la atomicidad como el número de átomos de un elemento en una sola molécula.
La manera precisa de nombrar estos compuestos es: prefijo-nombre genérico + prefijo-nombre específico
(Véase en la sección otras reglas nombre genérico y específico).
Los prefijos son palabras que anteponen al prefijo nombre del compuesto y representan el número de átomos que hay en la molécula del elemento. Existen diferentes prefijos los cuales provienen del griego y a continuación se presenta el número de átomos al que hace referencia el prefijo.
(Generalmente solo se utiliza hasta el prefijo hepta-)
| Prefijos griegos | Número de átomos |
| mono- | 1 |
| di- | 2 |
| tri- | 3 |
| tetra- | 4 |
| penta- | 5 |
| hexa- | 6 |
| hepta- | 7 |
| octa- | 8 |
| nona- | 9 |
| deca- | 10 |
- El prefijo mono- normalmente se elude salvo que haya posibilidad de confusión.
- Por ejemplo,
- CrBr3: tribromuro de cromo;
- CO: monóxido de carbono
- CO2: Dioxido de carbono
-
- En casos en los que en vez de átomos se trate de grupos de átomos como compuestos tales como sales dobles y triples, oxisales y similares, se pueden emplear los prefijos bis-, tris-, tetraquis, pentaquis, hexaquis, etc.
- Por ejemplo la fluorapatita Ca5F (PO4)3 : fluoruro tris(fosfato) de calcio, ya que si se usara el término trifosfato se estaría hablando del anión trifosfato [P3O10]5-, en cuyo caso sería:
- Ca5F (P3O10)3.
Nomenclatura stock con números romanos
Este sistema de nomenclatura se basa en nombrar a los metales en estado de oxidación, este no se escribe.
La valencia (o mejor dicho el estado de oxidación) es la que indica el número de electrones que un átomo pone en juego en un enlace químico; un número positivo cuando tiende a ceder los electrones, y un número negativo cuando tiende a ganar electrones. De forma general, bajo este sistema de nomenclatura, los compuestos se nombran de esta manera: nombre genérico + "de" + nombre del elemento específico + el estado de oxidación.
Normalmente, a menos que se haya simplificado la fórmula, la puede verse en el subíndice del otro elemento (en compuestos binarios y ternarios). Los números de valencia normalmente se colocan como subíndice del átomo (elemento) en una fórmula molecular.
Alternancia de valencias.- Ejemplo:
- Fe2S3, Fe2+3S3-2, sulfuro de hierro(III)
- SO3, S+6O3-2, óxido de azufre(VI)
- Figura 1.
- Tabla periodica con estados de oxidación
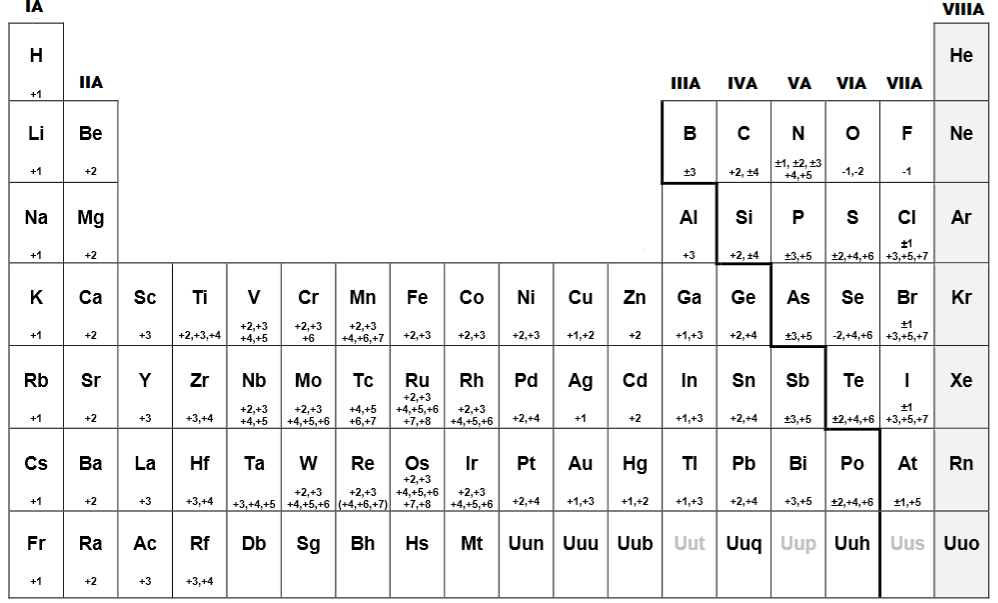
Fuente: https://misuperclase.com/tabla-periodica-con-numeros-de-oxidacion/
Nomenclatura tradicional, clásica o antigua
En este sistema de nomenclatura se indica la valencia del elemento de nombre específico con una serie de prefijos y sufijos. De manera general las reglas son:
- Cuando el elemento solo tiene una valencia, simplemente se coloca el nombre del elemento precedido de la sílaba “de” o bien se termina el nombre del elemento con el sufijo –ico.
- K2O, óxido de potasio u óxido potásico
- Cuando tiene dos valencias diferentes se usan los sufijos -oso e -ico.
- … -oso cuando el elemento usa la valencia menor: FeO, Fe+2O-2, hierro con la valencia 2, (estado de oxidación +2), óxido ferroso
- … -ico cuando el elemento usa la valencia mayor: Fe2O3, Fe2+3O3-2, hierro con valencia 3, (estado de oxidación +3), óxido férrico 3
- Cuando tiene tres distintas valencias se usan los prefijos y sufijos.
- hipo- … -oso (para la menor valencia): P2O, P2+1O-2, fósforo con la valencia 1, (estado de oxidación +1), óxido hipofosforoso
- … -oso (para la valencia intermedia): P2O3, P2+3O3-2, fósforo con valencia 3, (estado de oxidación +3), óxido fosforoso
- … -ico (para la mayor valencia): P2O5, P2+5O5-2, fósforo con valencia 5, (estado de oxidación +5), óxido fosfórico
- Cuando tiene cuatro valencias diferentes se usan los prefijos y sufijos
- hipo- … -oso (para la valencia más pequeña)
- … -oso (para la valencia pequeña)
- … -ico (para la valencia grande)
- per- … -ico (para la valencia más grande)
- Cuando tiene cinco valencias diferentes se usan los prefijos y sufijos:
- hipo- … -oso (para la valencia más pequeña)
- … -oso (para la valencia media-menor)
- … -ico (para la media)
- per- … -ico (para la valencia media-mayor)
- hiper- … -ico (para la valencia mayor)
Hoy esta nomenclatura está en desuso. Sin embargo aún se usa mucho en el comercio y la industria.
bibliografía
http://www2.udec.cl/quimles/general/guia-1.htm
https://es.wikipedia.org/wiki/Nomenclatura_qu%C3%ADmica_de_los_compuestos_inorg%C3%A1nicos


Comentarios
Publicar un comentario